L'Agence européenne des médicaments (EMA) a émis vendredi un avis favorable à l'utilisation provisoire de la combinaison de deux anticorps synthétiques de la compagnie américaine Regeneron, qui empêchent l'état des patients atteints du Covid-19 de s'aggraver.
Ce traitement a notamment été déployé l'an dernier à titre expérimental pour soigner l'ancien président américain Donald Trump.
Selon l'EMA, les résultats préliminaires montrent que le traitement au REGN-COV2 réduit la quantité de virus présente au fond du nez et de la gorge des patients testés positifs au Covid-19.
Le régulateur européen des médicaments affirme en avoir conclu que REGN-COV2 peut être utilisé comme traitement chez les patients "qui ne nécessitent pas d'oxygène supplémentaire et qui ne présentent pas un risque élevé d'évolution vers une forme sévère du Covid-19."
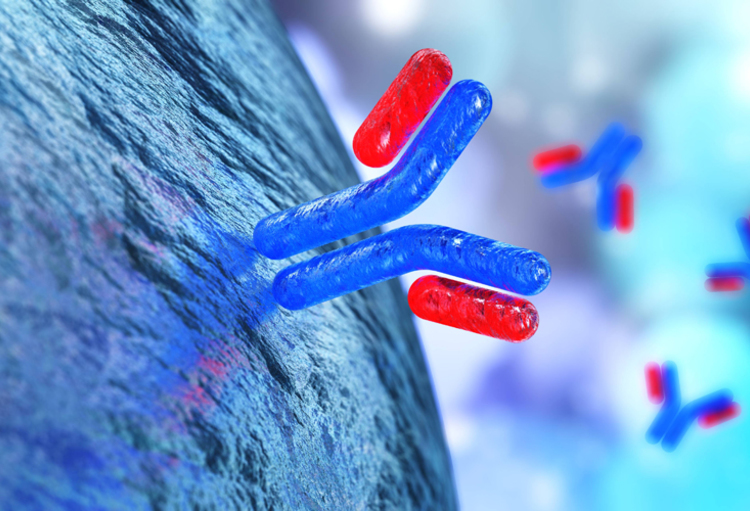
REGN-COV2 est une combinaison de casirivimab et d'imdevimab, deux anticorps monoclonaux administrés aux patients par perfusion, a déclaré l'EMA.
Fabriqués en laboratoire, ces anticorps de synthèse miment l'action des anticorps naturellement produits par le système immunitaire en cas d'infection.
Les deux anticorps, casirivimab et imdevimab, ont été conçus pour s'attaquer à la protéine S, qui forme les petites pointes à la surface du virus, a déclaré l'EMA. Ils s'agrippent à ces pointes, l'empêchant de s'arrimer à la cellule humaine pour l'infecter.
L'annonce fait suite à la réunion mensuelle de l'EMA, basée à Amsterdam, où elle a également recommandé l'approbation de six autres médicaments, notamment le premier traitement oral pour les patients atteints de certains types d'atrophie musculaire spinale, une maladie génétique rare et souvent mortelle qui provoque une faiblesse musculaire et une perte progressive de motricité.
L'Agence américaine des médicaments (FDA) a donné en novembre son autorisation d'urgence pour l'utilisation du REGN-COV2.
L'EMA n'a cependant pas fait d'annonce vendredi sur l'approbation du vaccin contre le Covid-19 de Johnson & Johnson, qui a demandé plus tôt ce mois-ci une autorisation pour l'Union européenne.
Un panel américain d'experts indépendants s'est réuni vendredi afin de se pencher sur un éventuel feu vert au déploiement du vaccin de Johnson & Johnson sur le sol américain.
L'Agence européenne des médicaments a, jusqu'à présent, autorisé trois vaccins au sein de l'UE: ceux de Pfizer/BioNTech, Moderna et AstraZeneca.